1
Artículo científico
Análisis comparativo en vida real del trastuzumab original y sus biosimilares: Seguridad, eficacia y coste-efectividad
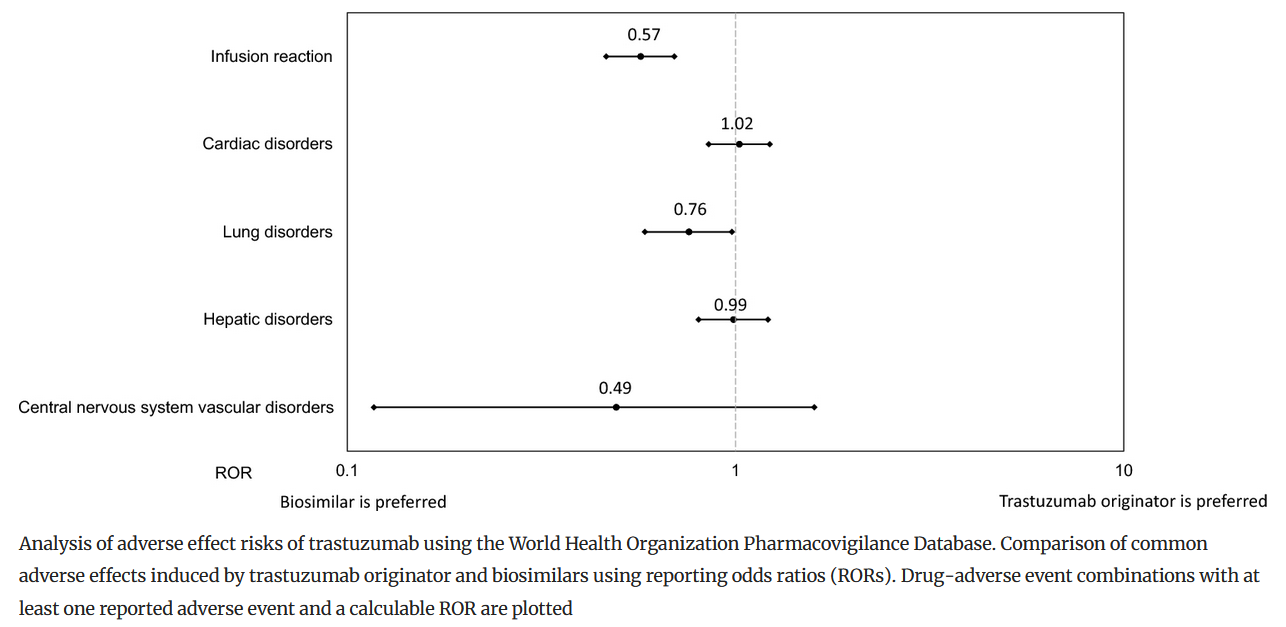 Este estudio trata de aportar evidencia acerca de la seguridad, eficacia y coste-efectividad del uso de trastuzumab biosimilar en el tratamiento del cáncer de mama HER2-positivo. Para ello, se analizaron grandes volúmenes de datos en vida real: resúmenes clínicos de altas hospitalarias, costes y eventos adversos de los pacientes tras recibir tratamiento con alguna de las versiones biosimilares disponibles o con el trastuzumab de referencia. Tras el análisis de los datos, se demuestra la seguridad, eficacia y mejora del coste-efectividad de las alternativas biosimilares, con una reducción del 50,1% de los costes de tratamiento por dosis. A la vista de los resultados, el estudio destaca la importancia de considerar el potencial de los biosimilares a la hora de definir las estrategias terapéuticas.
Este estudio trata de aportar evidencia acerca de la seguridad, eficacia y coste-efectividad del uso de trastuzumab biosimilar en el tratamiento del cáncer de mama HER2-positivo. Para ello, se analizaron grandes volúmenes de datos en vida real: resúmenes clínicos de altas hospitalarias, costes y eventos adversos de los pacientes tras recibir tratamiento con alguna de las versiones biosimilares disponibles o con el trastuzumab de referencia. Tras el análisis de los datos, se demuestra la seguridad, eficacia y mejora del coste-efectividad de las alternativas biosimilares, con una reducción del 50,1% de los costes de tratamiento por dosis. A la vista de los resultados, el estudio destaca la importancia de considerar el potencial de los biosimilares a la hora de definir las estrategias terapéuticas.
BioDrugs
https://link.springer.com/article/10.1007/s40259-024-00686-x
2
Vídeo
Biosimilares en el déficit de la hormona de crecimiento: somatropina
“Biosimilares en el déficit de la hormona de crecimiento: la somatropina” es el título del segundo videoconsejo de la nueva temporada de “Biosimilares y Farmacia”. En esta nueva entrega se explica en qué consiste el déficit de la hormona de crecimiento y sus síntomas, la existencia de biosimilares para tratarla y aspectos importantes a tener en cuenta relacionados con la administración y conservación del medicamento. Un dato de interés es que la somatropina fue el primer biosimilar aprobado en la Unión Europea, en el año 2006.
CGCOF, Medicina Televisión y BioSim
https://www.youtube.com/watch?v=MtZe0hxGO20
3
Vídeo
Congreso de Biosimilares en Cáncer 2024
Fundación CáncerVida
https://www.youtube.com/watch?v=57ryLJhNbIM&t=1875s
4
Artículo científico
La importancia de los datos del mundo real en la evaluación de la seguridad de los biosimilares: Un estudio descriptivo de la práctica clínica en una población oncohematológica italiana
El artículo demuestra, gracias a datos de práctica clínica real, la seguridad del uso de los biosimilares, centrándose en el uso de rituximab en una población italiana de pacientes con enfermedades oncohematológicas, como el linfoma no Hodgkin y la leucemia linfocítica crónica. Este estudio, que incluyó a 505 pacientes, analizó tanto el uso de rituximab de referencia como de dos de sus biosimilares, investigando específicamente la seguridad del intercambio entre el medicamento de referencia y un biosimilar o entre diferentes biosimilares. Los hallazgos sugieren que estos intercambios no incrementan significativamente los riesgos de reacciones adversas. Por tanto, el estudio respalda la seguridad de los biosimilares de rituximab y sugiere que su uso puede ayudar a reducir costes sin comprometer la seguridad de los pacientes en patologías oncohematológicas.
Cancers
https://www.mdpi.com/2072-6694/16/19/3419
5
Reporte
Aspectos destacados de la reunión del Comité de Medicamentos de Uso Humano de octubre 2024

El Comité de Medicamentos de Uso Humano de la Agencia Europea de Medicamentos, en su reunión de octubre, ha recomendado la aprobación de dos nuevos biosimilares de ustekinumab. En caso de que la Comisión Europea conceda a ambos la autorización de comercialización, serán nueve los biosimilares de ustekinumab aprobados en la Unión Europea. En España, ustekinumab fue el tercer medicamento de mayor consumo en PVL (Precio de Venta del Laboratorio) en hospitales en el año 2021, y el segundo en 2022, según la última versión disponible del “Informe de Prestación farmacéutica en el SNS”, por lo que la llegada de los biosimilares supone un enorme impacto tanto en el ahorro como el acceso de los pacientes a este tratamiento biológico.


