1
Artículo científico
Análisis de la regulación aplicada a un conjunto de ocho medicamentos biosimilares por parte de cuatro autoridades reguladoras de referencia
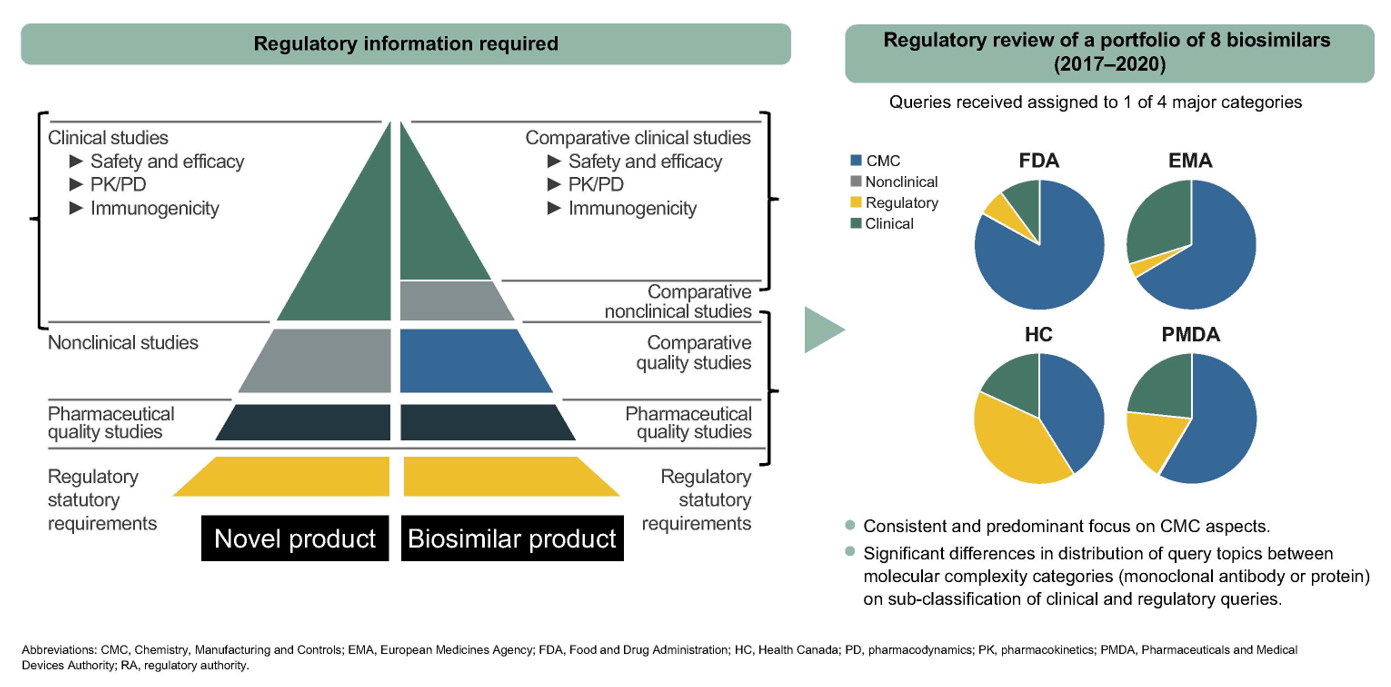
En este artículo se observa que existe una amplia y extendida evidencia científica avalada por las Agencias Reguladoras (AR) que sustenta las sólidas normas regulatorias que presentan estos países. Ciertamente existen diferentes enfoques a la hora de evaluar la relación beneficio-riesgo, aunque en última instancia se llega a la misma decisión regulatoria.
Se puede concluir, tras la revisión sistemática que el área de mayor atención de las AR se centró en la evaluación de los datos de información más relevante para la demostración de la biosimilitud, en los controles químicos y de fabricación y la justificación de la extrapolación de las indicaciones.
Analysis of the Regulatory Science Applied to a Single Portfolio of Eight Biosimilar Product Approvals by Four Key Regulatory Authorities. Ingram B, et al. Pharmaceuticals. 2021; 14(4):306.
https://www.mdpi.com/1424-8247/14/4/306
2
Artículo científico
Análisis de impacto presupuestario de los biosimilares en España. Periodo 2009-2019
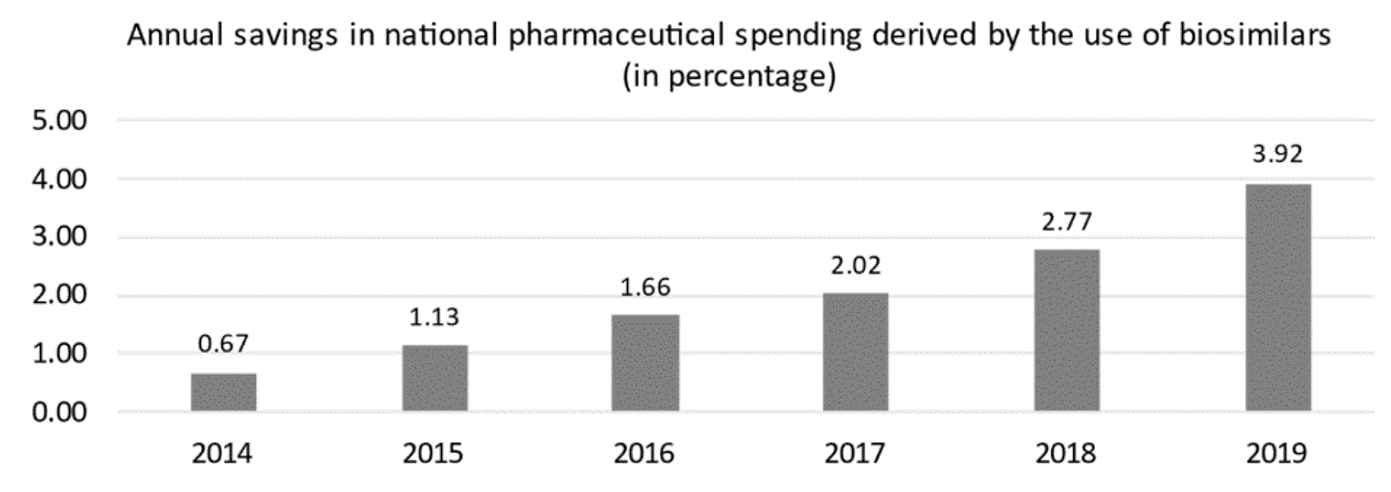
Los medicamentos biosimilares han demostrado ser una importante herramienta de la contención del gasto farmacéutico en medicamentos biológicos. Así lo demuestra este trabajo que aborda el análisis de impacto presupuestario de los biosimilares en el SNS de España entre 2009 y 2019. Las dos variables empleadas son consumo (envases realmente consumidos por el SNS) y precio (teniendo en cuenta los descuentos comerciales aplicados en los procedimientos de compra pública hospitalaria). En el estudio se han incluido los 13 principios activos con competencia biosimilar en el periodo analizado y se compara el gasto asociado a dichos principios activos en un escenario hipotético sin biosimilares, donde no habría habido bajadas de precio previsibles, y en el escenario real, donde originales y biosimilares compiten. La diferencia entre ambos es el impacto presupuestario, que en este caso ascendió a 2.300 millones de euros en 10 años. Los principios activos que concentran la mayor parte del ahorro son somatropina, epoetinas e infliximab. El impacto presupuestario de los biosimilares especialmente en el entorno hospitalario es evidente y solo en 2019 los ahorros generados supusieron el 4% del gasto farmacéutico total en dicho año.
El artículo se basa en el informe “Análisis de impacto presupuestario de los medicamentos biosimilares en el Sistema Nacional de Salud de España (2009-2022)” financiado por BioSim.
Budget Impact Analysis of Biosimilar Products in Spain in the Period 2009–2019. García-Goñi, M. et al. Pharmaceuticals 2021, 14, 348.
https://doi.org/10.3390/ph14040348
3
Informe
Revisión del Mercado de Medicamentos Biosimilares en Europa. Visión General sobre Políticas

Medicines for Europe.
https://www.medicinesforeurope.com/wp-content/uploads/2021/03/Biosimilar%20Market%20Review-Final.pdf
4
Informe
Capítulo sobre los resultados de las políticas de switch a medicamentos biosimilares en Canadá
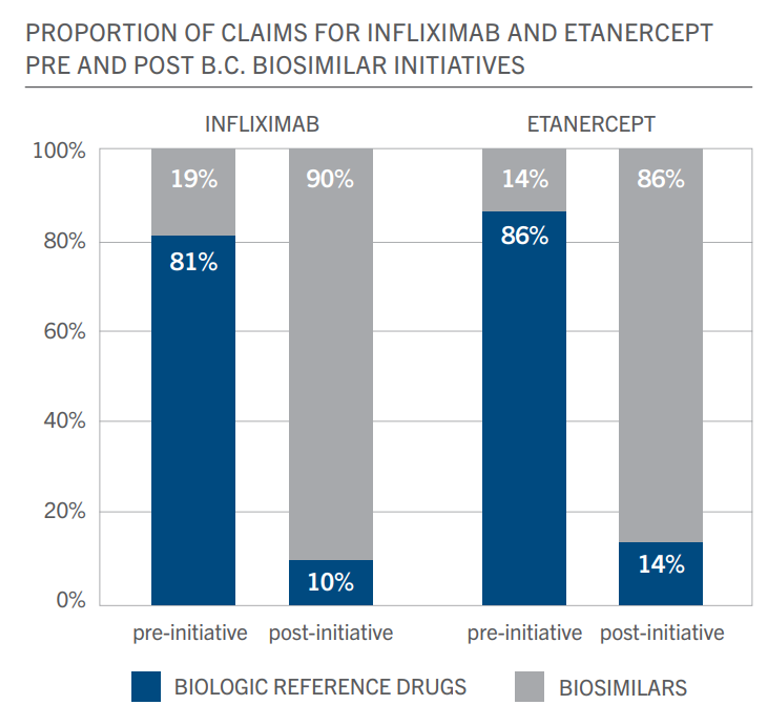
Canadá está siendo un país especialmente activo en lo relativo a aumentar los niveles de utilización de biosimilares a través de programas de switch obligatorio de original a biosimilar. A nivel central la administración canadiense ha dedicado importantes esfuerzos a evaluar su nivel de uso de biosimilares respecto a la OCDE y los ahorros potenciales de mejorar estos niveles. Además, ha habido una tendencia creciente a la difusión de materiales oficiales donde se informa sobre las garantías de calidad, seguridad y eficacia de los medicamentos biosimilares y se anima a fomentar su uso.
La Columbia británica fue pionera en este programa de switch obligatorio. Le han seguido otras provincias canadienses y se ha extendido a varios principios activos. Aunque este es un informe general sobre medicamentos, cabe destacar el capítulo centrado en los biosimilares (páginas 16-19) ya que muestra los llamativos resultados de las políticas de switch en la utilización de biosimilares: los biosimilares de anti-TNFs infliximab y etanercept han pasado de representar menos del 20% a más del 85% de utilización de estos principios activos gracias a la iniciativa de switch en la Columbia británica.
Prescription drug trend Report-Canada.
5
Artículo científico
Un vistazo al histórico de la adopción de biosimilares de Infliximab y Etanercept en Inglaterra, Escocia y Gales
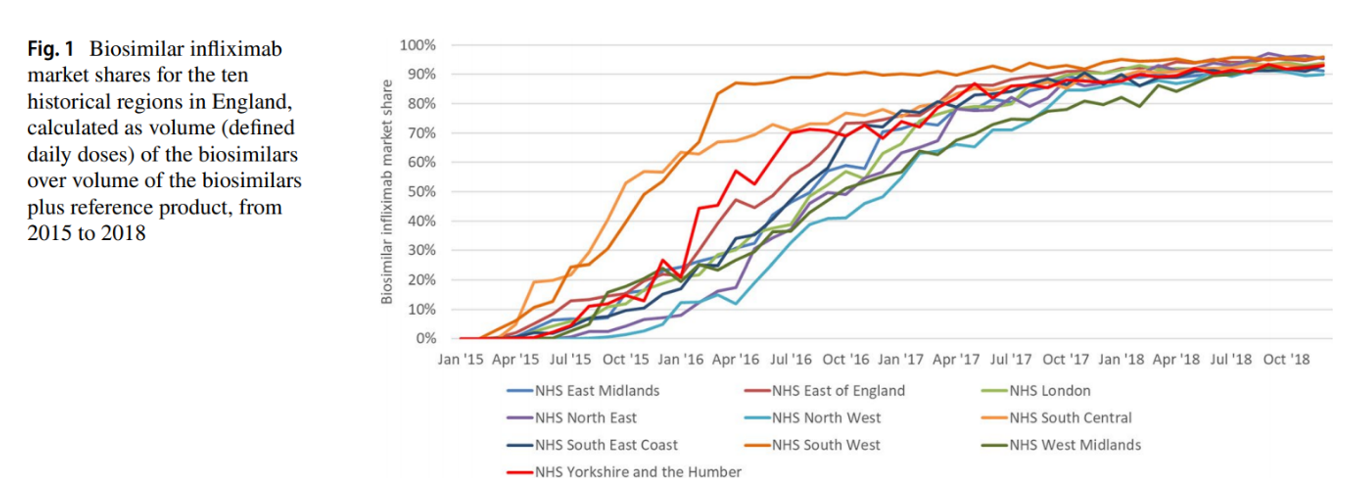
A Look at the History of Biosimilar Adoption: Characteristics of Early and Late Adopters of Infliximab and Etanercept Biosimilars in Subregions of England, Scotland and Wales - A Mixed Methods Study.” Moorkens, E et al. BioDrugs: clinical immunotherapeutics, biopharmaceuticals and gene therapy vol. 35,1 (2021): 75-87.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7803694/pdf/40259_2020_Article_456.pdf