1
Artículo
Comparabilidad de biológicos: principios generales, consistencia de la evidencia y confianza no alcanzada
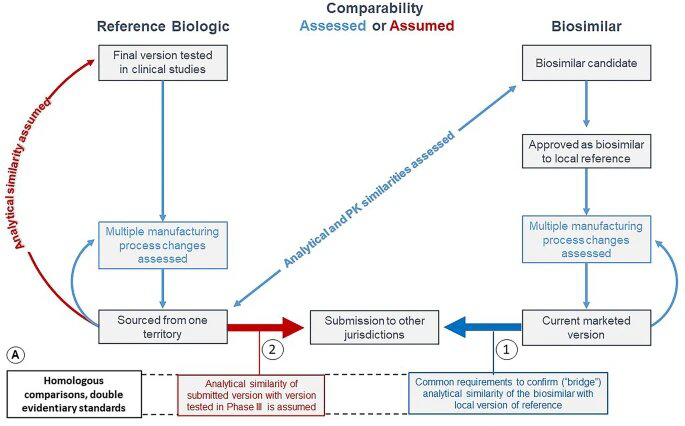
Webster C. J. et al. Comparability of Biologics: Global Principles, Evidentiary Consistency and Unrealized Reliance. BioDrugs, 2021
https://doi.org/10.1007/s40259-021-00488-5
2
Informe
Una visión de la Industria Global de Genéricos y Biosimilares
El objetivo es hacer frente a las desigualdades en la atención sanitaria, para lo que genéricos y biosimilares han sido una potente herramienta de acceso para los pacientes, así como apoyo para la sostenibilidad. La disponibilidad de medicamentos fuera de patente con mismas garantías para la salud de los pacientes y menor coste para los sistemas sanitarios a nivel mundial ha sido clave para poder hacer frente a la pandemia por la COVID-19.
A Vision for the Global Generic and Biosimilar Medicines Industry Whitepaper May 2021. International Generic and Biosimilar Association, IGBA
3
Artículo
Políticas para fomentar el uso de biosimilares en los países europeos y su posible impacto en el gasto farmacéutico
Este trabajo identifica diferentes políticas de regulación del precio de medicamentos biológicos originales y sus biosimilares empleadas por 16 países europeo, y explora su potencial impacto en el ahorro derivado del uso de los medicamentos biosimilares en Alemania. Las políticas de precios se analizaron a través de una encuesta a las autoridades de estos países. El gasto en Alemania, empleando sus datos de consumo y precios (caso base) se comparó con el gasto si se hubieran aplicado las diferentes medidas identificadas (5 escenarios). La diferencia entre cada uno de ellos y el caso base resultó en el ahorro potencial. El mayor ahorro se consiguió en el escenario 1 ('precios europeos'), que consideraba los precios de lista oficiales de otros países de la muestra. Considerar también los precios en otros países (escenario 5: 'RPS-Europa') para el cálculo del precio de referencia logró el segundo mayor ahorro en comparación con el caso base. En resumen, los resultados arrojan una variación en el ahorro potencial en Alemania de entre el 5% y el 55%, lo que sugiere que algunas políticas de precio pueden tener un papel realmente importante en los ahorros derivados de la competencia biosimilar. Sugieren que el seguimiento y la evaluación de estas medidas son clave para obtener una imagen más completa de su impacto.
Vogler S. et al. Policies to Encourage the Use of Biosimilars in European Countries and Their Potential Impact on Pharmaceutical Expenditure Front Pharmacol. 2021; 12: 625296
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8267415/pdf/fphar-12-625296.pdf
4
Reseña
El retraso en la entrada de biosimilares de adalimumab en EE. UU. conlleva importantes pérdidas de ahorro para Medicare

Hagen, T. Study: Medicare's Lost Savings Due to Delayed Adalimumab Biosimilar Entry. The Center for Biosimilars, July 12, 2021
5
Artículo
Medicamentos biosimilares: OsMed informa sobre el seguimiento del consumo y el gasto en Italia
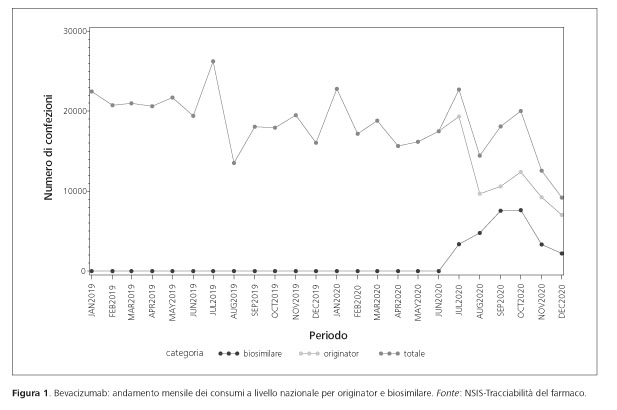
Zito S. et al. Farmaci biosimilari: i rapporti OsMed sul monitoraggio dei consumi e della spesa in Italia. Recenti Prog Med 2021;112(7):504-509 | doi 10.1701/3638.36185
https://www.recentiprogressi.it/archivio/3638/articoli/36185/