1
Artículo científico
Análisis cualitativo del diseño y la aplicación de los programas de reparto de beneficios aplicados a medicamentos biológicos en Europa
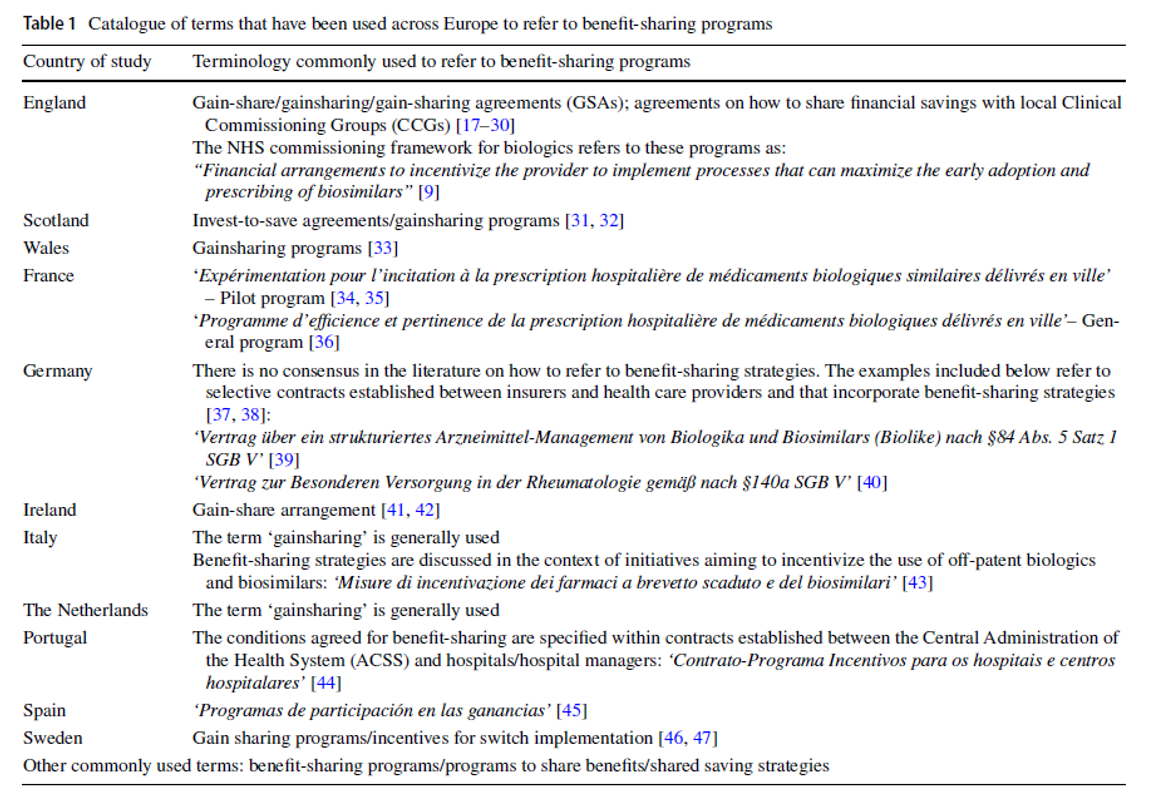
Barcina Lacosta, T. et al. Qualitative Analysis of the Design and Implementation of Benefit-Sharing Programs for Biologics Across Europe. BioDrugs, 2022
https://doi.org/10.1007/s40259-022-00523-z
2
Video
De los medicamentos biológicos a los biosimilares: ¿Conoces el camino?

Cruz, E. 2022. Aula abierta, Universidad Europea
https://www.youtube.com/watch?v=hcgUE4HAM4g
3
Web interactiva
Utilización de medicamentos biosimilares en Portugal
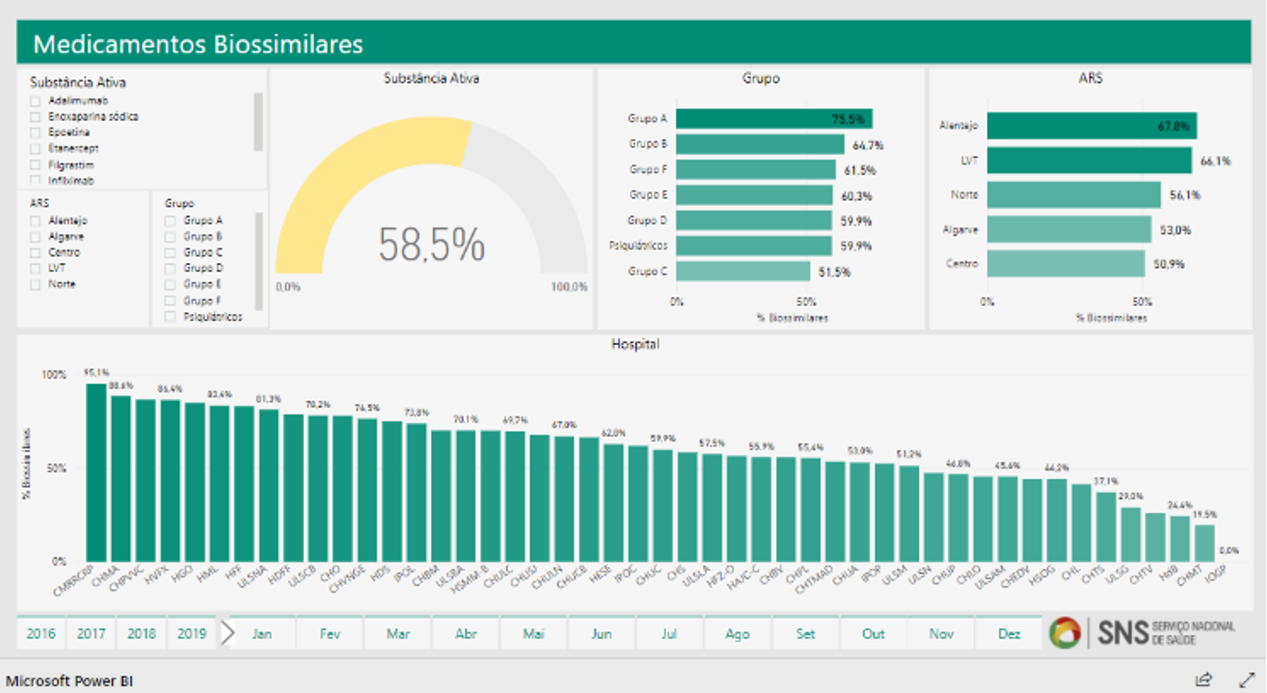
Infarmed
https://www.infarmed.pt/web/infarmed/entidades/farmacia-hospitalar/medicamentos-biossimilares
4
Artículo científico
Una introducción a los biosimilares para el tratamiento de las enfermedades de la retina: Una revisión narrativa
Esta revisión pone de relieve que los anti-VEGF (anti-factor de crecimiento endotelial vascular) son muy efectivos para el tratamiento de las enfermedades de la retina, pero el precio puede limitar potencialmente la intensidad o la duración de la terapia y, por lo tanto, proporcionar resultados clínicos subóptimos. Actualmente, varios candidatos biosimilares de ranibizumab y aflibercept (ambos anti-VEGF) están en desarrollo para el tratamiento de enfermedades de la retina y en algunas casos han recibido ya aprobación regulatoria. La llegada de estos biosimilares al mercado se espera con interés, pues supondrán alternativas para optimizar los resultados clínicos al tiempo que proporcionan ahorros de costes sustanciales que pueden reinvertirse en los sistemas de atención médica. Esta revisión ofrece también una amplia explicación del proceso regulatorio al que son sometidos los medicamentos biosimilares de forma previa a su autorización y que va encaminado a asegurar las mismas garantías de calidad, seguridad y eficacia que el fármaco original.
Hariprasad, S.M. et al. Ophthalmol Ther 2022
https://doi.org/10.1007/s40123-022-00488-w
5
Artículo científico
Implementación y optimización del uso de biosimilares en la Clínica Mayo
Este artículo describe la estrategia de la Clínica Mayo (EE.UU.) para optimizar el uso de medicamentos biosimilares. Para ello, se creó e impartió formación a un equipo multidisclinar sobre el intercambio terapeutico, que sería liderado por farmacéuticos y se mejoraron los registros médicos electrónicos. El proyecto se centró en el uso de medicamentos de referencia y biosimilares para 5 principios activos (bevacizumab, epoetin alfa, filgrastim, rituximab y trastuzumab) en todas las localizaciones de la Clínica Mayo. Los resultados mostraron que en el período posterior a la implementación de esta iniciativa, el aumento del porcentaje absoluto de biosimilares elegidos en el formulario fue del 69 % para bevacizumab, 63 % para epoetina alfa, 80% para filgrastim, 79% para rituximab y 72 % para trastuzumab. Los ahorros generados a los 12 meses fueron de 23,1 millones de dólares en total. En conjunto demuestra el éxito de la estrategia adoptada.
Jensen. C, et. al. Marzo 2022. Mayo Clinic Proceedings
https://www.mayoclinicproceedings.org/article/S0025-6196(22)00119-7/fulltext

