1
Infografía
Peso por área terapéutica de los nuevos biosimilares
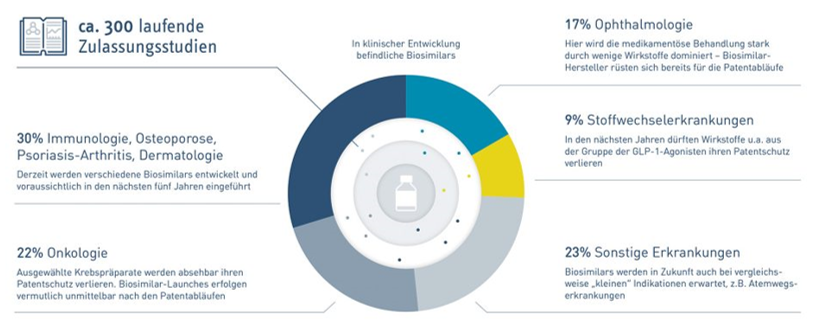
El número de enfermedades contra las que se utilizan está aumentando, por ejemplo, en oncología, inmunología, oftalmología y dermatología, lo que significa costes decrecientes y más acceso para los pacientes. Según sus datos, un 30% son para biosimilares indicados en inmunología, un 22% en oncología, 17% en oftalmología, 9% en enfermedades metabólicas y 23% en otras enfermedades.
AG Pro biosimilars
https://probiosimilars.de/grafik-des-monats/april-2022/
2
Informe de reunión
Consulta informal de la OMS sobre la revisión de las directrices para la evaluación de productos biosimilares
Este documento refleja las reflexiones y acuerdos de un grupo de expertos de regulación a nivel internacional (Unión Europea, China, Japón, EE. UU., Canadá, Corea del Sur, Ghana y Argentina) que fueron consultados por la Organización Mundial de la Salud (OMS) para promover la revisión de sus directrices sobre la evaluación de biosimilares adoptadas en 2009. Cabe destacar algunas conclusiones sobre los aspectos del desarrollo clínico. En cuanto a la no necesidad de un ensayo clínico comparativo de fase 3, si se pueden extraer pruebas suficientes de biosimilitud de otras partes del ejercicio de comparabilidad, se consideró que era inapropiado y se prefería el uso de ensayo de eficacia con potencia adecuada, ya que esta es la terminología que se utiliza a menudo en las directrices reguladoras sobre biosimilares. Otro punto de gran preocupación fue si los datos de seguridad de la evaluación clínica limitada serán adecuados dado que la importancia de la seguridad, incluyendo la inmunogenicidad, no debe ser subestimada.
Wadhwa, M.et al. Abril 2022. Biologicals
https://pubmed.ncbi.nlm.nih.gov/35466023/
3
Infografías
Casos de estudio de biosimilares
El “Case Study — Level 1. Foundational Concepts” ejemplifica como una enfermera recién graduada mantiene un diálogo con una enfermera especializada en reumatología sobre medicamentos biosimilares. Así, la última le explica las diferencias entre genérico y biosimilar, las diferencias entre lotes de medicamentos biológicos, o las ventajas económicas para el sistema sanitario entre otras cuestiones.
El “Case Study — Level 2: Regulatory and Scientific Concepts” ilustra cómo un médico prescriptor se encuentra ante la tesitura de prescribir un biosimilar por primera vez. Para resolver algunas dudas acude a la página web de la FDA y hace uso de los recursos sobre biosimilares destinados a tal fin. Además, el documento incluye una breve conversación médico-paciente que refleja la toma de decisión compartida en la que la confianza del médico es clave para la aceptación del paciente.
FDA
https://www.fda.gov/media/154918/download
https://www.fda.gov/media/154919/download
4
Artículo científico
Efectividad en vida real de los biosimilares de adalimumab en pacientes con psoriasis crónica en placa
El objetivo principal de este estudio era analizar la supervivencia del fármaco adalimumab en pacientes con psoriasis crónica en placas y los factores asociados a su interrupción. Se analizó la supervivencia del fármaco a 1 año y los factores independientes asociados a su interrupción en un total de 410 pacientes. La supervivencia adalimumab a un año fue del 81,5% en la población general del estudio. La obesidad se asoció a un mayor riesgo de interrupción del adalimumab, mientras que la artritis psoriásica y el hecho de recibir adalimumab como primer tratamiento sistémico se asociaron a un menor riesgo. Concluyen que la eficacia en vida real de los biosimilares es coherente con la registrada anteriormente para el original. Se espera que el perfil favorable de coste-eficacia de los biosimilares no sólo permitirá un mayor acceso a los de la psoriasis, sino que también redefina el estándar de la psoriasis. Teniendo en cuenta los crecientes costes sanitarios, empezar a tratar a los pacientes con biosimilares puede reducir el coste del tratamiento a la vez que mantiene una atención de alta calidad.
Bellinato, F et al. Dermatology and Therapy, abril 2022
https://link.springer.com/article/10.1007/s13555-022-00732-y
5
Webinar
Gain-sharing: nueva estrategia de acuerdos con biosimilares. SEFH

El presidente de BioSim ofreció una introducción al concepto de gainsharing (acuerdo de ganancias compartidas) y una revisión de los casos de éxito internacionales. Por último, trasladó los avances en la implantación de este tipo de incentivos en las CCAA.
El Dr. Calleja, por su parte, puso en valor la eficiencia que aportan los biosimilares en la terapia biológica y su visión sobre los acuerdos de ganancias compartidas vinculados a estos medicamentos desde la práctica asistencial. Por ejemplo, resaltando el papel del farmacéutico hospitalario en el switch entre medicamento original y biosimilar que va vinculado a este tipo de acuerdos.

