1
Informe
Actualización del Horizon Scanning de biosimilares
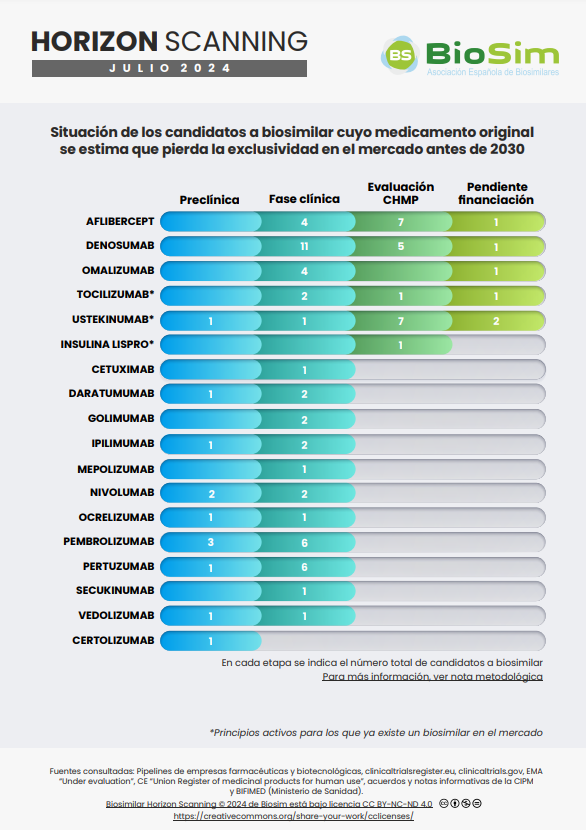 BioSim publica la actualización semestral del informe Horizon Scanning que muestra la potencial llegada al mercado de nuevos medicamentos biosimilares. Con la actualización de este documento, se pretende continuar con el apoyo en los procesos de planificación y decisión de las diferentes partes implicadas en la prestación farmacéutica: optimización de los procesos de compra, soporte en la revisión de los posicionamientos y protocolos terapéuticos una vez un principio activo biológico esté sometido a competencia biosimilar, etc. Además de incorporar nuevos ensayos clínicos de distintos candidatos a biosimilar, esta actualización anticipa la llegada de nuevos biosimilares de ustekinumab, denosumab, omalizumab y tocilizumab, que avanzan a la fase de financiación tras haber obtenido la autorización de comercialización de la Comisión Europea. En la segunda parte, se observa un ligero aumento de los hospitales españoles participantes en ensayos clínicos de diferentes biosimilares incluidos en el informe, debido, principalmente, al inicio de varios ensayos de candidatos a biosimilar de pembrolizumab. Además, esta actualización viene acompañada de una nota metodológica que describe y aclara varios conceptos que facilitan su correcta interpretación.
BioSim publica la actualización semestral del informe Horizon Scanning que muestra la potencial llegada al mercado de nuevos medicamentos biosimilares. Con la actualización de este documento, se pretende continuar con el apoyo en los procesos de planificación y decisión de las diferentes partes implicadas en la prestación farmacéutica: optimización de los procesos de compra, soporte en la revisión de los posicionamientos y protocolos terapéuticos una vez un principio activo biológico esté sometido a competencia biosimilar, etc. Además de incorporar nuevos ensayos clínicos de distintos candidatos a biosimilar, esta actualización anticipa la llegada de nuevos biosimilares de ustekinumab, denosumab, omalizumab y tocilizumab, que avanzan a la fase de financiación tras haber obtenido la autorización de comercialización de la Comisión Europea. En la segunda parte, se observa un ligero aumento de los hospitales españoles participantes en ensayos clínicos de diferentes biosimilares incluidos en el informe, debido, principalmente, al inicio de varios ensayos de candidatos a biosimilar de pembrolizumab. Además, esta actualización viene acompañada de una nota metodológica que describe y aclara varios conceptos que facilitan su correcta interpretación.
BioSim
https://www.biosim.es/horizon-scanning/
2
Artículo científico
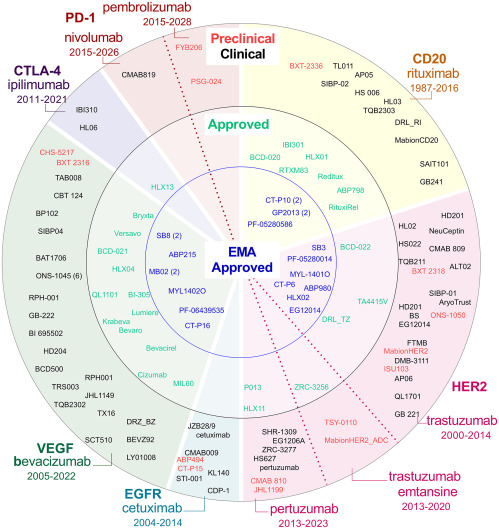
Anticuerpos monoclonales biosimilares para el tratamiento del cáncer
iScience
https://www.cell.com/iscience/
3
Guía
Consideraciones para demostrar intercambiabilidad con un producto de referencia: Actualización

Food and Drug Administration (FDA)
4
Artículo científico
Resultados clínicos del cambio a adalimumab biosimilar en pacientes con artritis reumatoide: Registro español RESTART
El artículo describe un estudio retrospectivo multicéntrico que emplea datos de las historias clínicas de pacientes diagnosticados de artritis reumatoide en España. A partir de estos datos en vida real, se busca demostrar la eficacia y seguridad del intercambio, tanto entre el medicamento original y un biosimilar de adalimumab, como entre diferentes biosimilares, debiendo haber mantenido el tratamiento tras el intercambio durante al menos 6 meses. Tras la evaluación de 86 pacientes, sólo el 3,5% de los pacientes recibió tratamiento biológico antes del adalimumab. Tras la finalización del estudio, la mediana del índice clínico de la actividad de la enfermedad (CDAI) y la del DAS28-CRP, variable fundamental para valorar la actividad de la artritis reumatoide, se mantuvieron en valores similares, confirmando la eficacia y seguridad del adalimumab biosimilar tras el intercambio.
Current Medical Research and Opinion
https://www.tandfonline.com/doi/full/10.1080/03007995.2024.2372295?af=R
5
Artículo científico
Impacto en el ahorro de costes del trastuzumab biosimilar para el tratamiento del cáncer de mama HER-2 positivo en un hospital
Este nuevo artículo, que recoge un estudio llevado a cabo en un hospital español, demuestra que, tras la llegada de los biosimilares de trastuzumab, la reducción del coste del tratamiento del cáncer de mama HER-2 positivo con este anticuerpo monoclonal se reduce en más de un 80%, permitiendo, además, el mayor acceso a estos tratamientos. Este estudio, junto a otro incluido en el mismo número de la revista, que investiga la persistencia en la práctica clínica del adalimumab de referencia y biosimilar en otro hospital español, refleja el creciente interés de los centros sanitarios españoles por los medicamentos biosimilares, reconociéndolos como la perfecta herramienta para asegurar la sostenibilidad del SNS y acceso a terapias biológicas.

